
7月15日下午,国家药品监督管理局的一纸公告,给大牛股长生生物一记“重拳”。
公告显示,国家药品监督管理局组织对长春长生生物科技有限责任公司(长春长生)开展飞行检查,发现该企业冻干人用狂犬病疫苗生产存在记录造假等严重违反《药品生产质量管理规范》行为。
而此次涉事的长春长生为上市公司长生生物的重要子公司。

幸运的是,公告称所有涉事批次产品尚未出厂和上市销售,全部产品已得到有效控制。
中证君第一时间联系了长生生物董秘赵春志。他说,冻干人用狂犬病疫苗销售收入约占长春长生总收入的一半左右,此次事件不涉及公司其他疫苗产品,现在冻干人用狂犬病疫苗生产存在记录造假具体原因还不知道,等待相关部门调查结果。
为什么生产记录如此重要呢?
要生产一批药品,所涉及的有关记录主要包括:
1、供应部门的原铺料进货记录;
2、仓储原铺料以及产品的进、出货记录;
3、财务部门的相应原铺料购买凭证和记录;
4、质检部门相应的原铺料以及产品的取样记录、检验记录、检验报告单等;
5、生产部门的领用记录、批生产记录;
6、销售部门的产品调出记录等。
而批生产记录的内容包括产品名称、生产批号、生产日期、操作者与复核者的签名、有关操作与设备、相关生产阶段的产品数量、物料平衡的计算、生产过程的控制记录及特殊问题记录。
此次长生生物涉及的就是生产记录。
贡献上市公司主要净利润
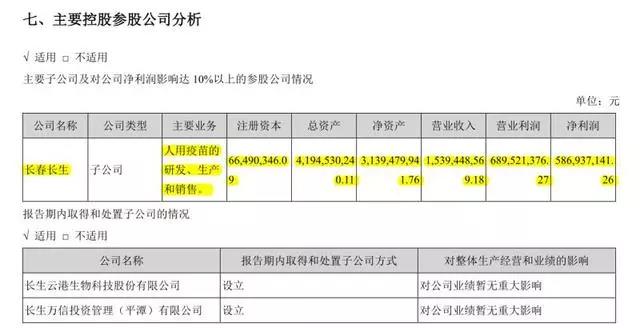
事实上,长春长生是长生生物的核心子公司及净利润主要贡献者。长生生物是国内疫苗企业产品品类最为丰富的民营企业之一,其疫苗销售业务占公司总营收的99%以上。而长春长生为长生生物的全资子公司,同时也是最主要利润贡献者。
年报数据显示,长春长生2017年的归母净利润为5.87亿元,而长生生物2017年的净利润为5.66亿元。
作为此次涉事公司,长春长生目前在售产品包括冻干水痘减毒活疫苗、冻干人用狂犬疫苗(Vero细胞)、冻干甲型肝炎减毒活疫苗、流行性感冒裂解疫苗、吸附无细胞百白破联合疫苗和ACYW 135 群脑膜炎球菌多糖疫苗。
2017年年报显示,从批签发数量看,公司狂犬疫苗和水痘疫苗已经位居国内第二位。

据媒体报道,事发后,长生生物已经发布紧急通知,要求各省份推广团队立即通知辖区内的区县疾控机构及接种单位,立即停止使用该公司的狂犬疫苗,立即就地封存该公司狂犬疫苗。
长生生物在通知中强调,该公司立即启动召回程序,请各单位按召回规定给予配合。并要求各推广团队采用传真、电话、网络等形式,通知到辖区各区县及接种单位。
针对公司GMP证书被收回,赵春志表示,待调查结果出来以及整改之后,公司可以重新申请GMP证书。
不过,“重新申请GMP证书短则一两个月,长则半年。”鼎臣医药咨询创始人史立臣说,由于严格按照GMP要求来生产药品的话,药企生产成本会很高,所以就造成很多药企在药品生产、管理等方面不重视,存在各种问题,近期诸多药企被吊销GMP证书就是一个佐证。
